Как решать уравнения реакции
- Как решать уравнения реакций: основные шаги
- Изучите основные классы соединений
- Обратите внимание на электронейтральность формулы
- Расставьте коэффициенты
- Подсчитайте количество химических элементов
Как решать уравнения реакций: основные шаги
Часто при выполнении самостоятельных и контрольных работ встречаются задания, которые требуют решения уравнений реакций. Однако без определенных знаний и умений даже самые простые химические уравнения могут стать непреодолимым испытанием.
Изучите основные классы соединений
Перед тем, как приступить к решению уравнений реакций, необходимо изучить основные классы органических и неорганических соединений. Если вы не уверены в своих знаниях, можно подготовить шпаргалку, которая поможет вам во время выполнения задания. Постепенно, с практикой, все необходимые знания и умения запомнятся.
Ознакомьтесь с химическими свойствами и способами получения соединений
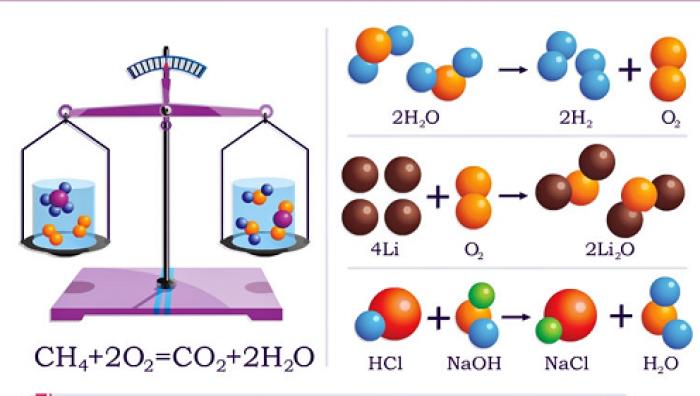
Основным материалом, который нужно изучить, являются химические свойства и способы получения каждого класса соединений. Обычно они представлены в виде общих схем, например: 1. кислота + основание = соль + вода 2. кислотный оксид + основание = соль + вода 3. основный оксид + кислота = соль + вода 4. металл + (разб) кислота = соль + водород 5. растворимая соль + растворимая соль = нерастворимая соль + растворимая соль 6. растворимая соль + щелочь = нерастворимое основание + растворимая соль. Используя таблицу растворимости солей, кислот и оснований, а также схемы-шпаргалки, можно решать уравнения реакций. Главное - иметь полный перечень таких схем и знать формулы и названия различных классов соединений.
Обратите внимание на электронейтральность формулы
После того, как вы определили формулу соединения, убедитесь, что она электронейтральна. Это означает, что количество положительных зарядов должно совпадать с количеством отрицательных зарядов. При этом не забывайте учитывать индексы, которые нужно перемножить на соответствующие заряды.
Расставьте коэффициенты
Если вы уверены в правильности формулы химической реакции, можно приступить к расстановке коэффициентов. Химическое уравнение представляет собой условную запись реакции с помощью химических символов, индексов и коэффициентов. При этом нужно придерживаться определенных правил:
- Коэффициент ставится перед химической формулой и относится ко всем элементам, входящим в соединение.
- Индекс ставится после химического элемента ниже, и относится только к элементу, стоящему слева от него.
- Если функциональная группа (например, кислотный остаток или гидроксильная группа) находится в скобках, то два рядом стоящих индекса (перед скобкой и после нее) нужно перемножить.
- При подсчете атомов химического элемента коэффициент умножается на индекс.
Подсчитайте количество химических элементов
Далее подсчитайте количество каждого химического элемента таким образом, чтобы суммарное число элементов, входящих в исходные вещества, совпадало с числом атомов, входящих в продукты реакции. С помощью анализа и правил, описанных выше, вы сможете решать уравнения реакций и цепочек превращений веществ.
