Как изменится массовое число при распаде
- Ядерные реакции и их отличие от химических
- Химические элементы и их изотопы
- Описание протонов, нейтронов и их массы
- Обозначения изотопов и элементарных частиц
- Именование изотопов элементов
- Стабильные и радиоактивные изотопы
- Виды радиоактивного распада
- Ra(226, 88) → Rn(222, 86) + He(4, 2).
Ядерные реакции и их отличие от химических
Ядра атомов, состоящие из протонов и нейтронов, могут претерпевать различные превращения в ядерных реакциях. Это является ключевым отличием таких реакций от химических, которые влияют только на электроны.
Химические элементы и их изотопы
Согласно современным химическим представлениям, элементы - это разновидности атомов с одинаковым зарядом ядра, который отражен в порядковом номере элемента в таблице Д.И. Менделеева. Изотопы этих элементов могут отличаться количеством нейтронов и, соответственно, атомной массой, но имеют одинаковое количество протонов, что указывает на то, что это один и тот же элемент.
Описание протонов, нейтронов и их массы
Протон имеет массу 1,0073 а.е.м. (атомные единицы массы) и заряд +1, в то время как нейтрон имеет массу 1,0087 а.е.м. Обозначение изотопа включает указание его атомной массы, составленной из протонов и нейтронов, и заряда ядра (числа протонов или порядкового номера).
Обозначения изотопов и элементарных частиц
Обозначение изотопов и элементарных частиц включает запись атомной массы над символом элемента и порядкового номера под символом элемента. Например, β-лучам, которые представляют собой электроны с пренебрежительно малой массой, присваивается заряд -1 и массовое число 0. α-частицы, положительные двухзарядные ионы гелия, обозначаются символом "He" с зарядом ядра 2 и массовым числом 4.
Именование изотопов элементов
Изотопы элементов обычно не имеют отдельных названий, за исключением водорода. Например, изотопом водорода с массовым числом 1 является протий, с массовым числом 2 - дейтерий, а с массовым числом 3 - тритий. Специальные наименования введены из-за значительного различия массы этих изотопов.
Стабильные и радиоактивные изотопы
Изотопы могут быть стабильными или радиоактивными. Стабильные изотопы не подвергаются распаду и поэтому сохраняются в природе в неизменном состоянии. Примеры стабильных изотопов включают кислород с атомной массой 16, углерод с атомной массой 12 и фтор с атомной массой 19.
Виды радиоактивного распада
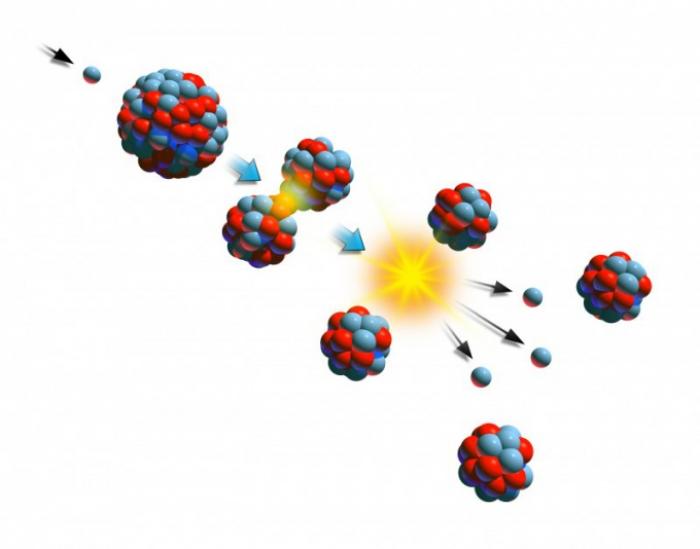
Радиоактивные изотопы, как естественные, так и искусственные, самопроизвольно распадаются, испуская α- или β-частицы до образования стабильного изотопа.
Существуют три вида самопроизвольных ядерных превращений: α-распад, β-распад и γ-распад. При α-распаде ядро испускает α-частицу, состоящую из двух протонов и двух нейтронов. Массовое число изотопа уменьшается на 4, а заряд ядра уменьшается на 2. Например, радий распадается на радон и ион гелия:
Ra(226, 88) → Rn(222, 86) + He(4, 2).
При β-распаде нейтрон в неустойчивом ядре превращается в протон, и ядро испускает β-частицу и антинейтрино. Массовое число изотопа остается неизменным, но заряд ядра увеличивается на 1.
При γ-распаде возбужденное ядро испускает γ-излучение с малой длиной волны. При этом энергия ядра уменьшается, но заряд ядра и массовое число остаются неизменными.