Как определить заряд ядра атома
- Строение атома и его характеристики
- Таблица Д.И.Менделеева и расположение химических элементов
- Структура атома
- Определение заряда ядра атома
- Примеры определения заряда ядра атома
Строение атома и его характеристики
Строение атома – это одна из базовых тем курса химии, которая основана на умении пользоваться таблицей «Периодическая система химических элементов Д.И.Менделеева». Это не только систематизированные и расположенные по определенным законам химические элементы, но и кладезь информации, в том числе и о строении атома. Зная особенности чтения этого уникального справочного материала, можно дать полную качественную и количественную характеристику атому.
Таблица Д.И.Менделеева и расположение химических элементов
В таблице Д.И.Менделеева, как в многоэтажном многоквартирном доме «живут» химические элементы, каждый из которых занимает свою собственную квартиру. Таким образом, каждый из элементов имеет определенный порядковый номер, указанный в таблице. Нумерация химических элементов начинается слева направо, причем сверху. В таблице горизонтальные ряды называются периодами, а вертикальные столбцы – группами. Это немаловажно, потому что по номеру группы или периода можно также дать характеристику некоторым параметрам атома.
Структура атома
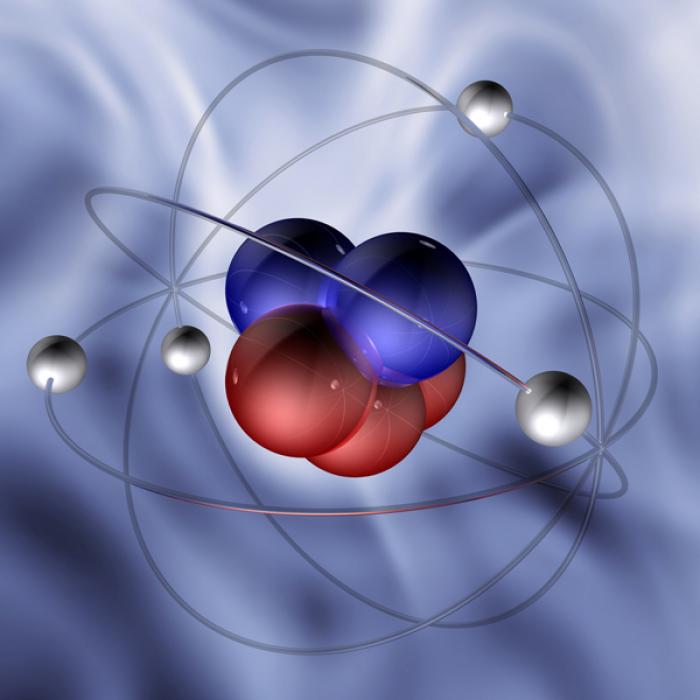
Атом представляет собой химически неделимую частицу, но при этом состоящую из более мелких составных частей, к которым можно отнести протоны (положительно заряженные частицы), электроны (заряжены отрицательно) и нейтроны (нейтральные частицы). Основная масса атома сосредоточена в ядре (за счет протонов и нейтронов), вокруг которого вращаются электроны. В целом атом электронейтрален, то есть в нем количество положительных зарядов совпадает с количеством отрицательных, следовательно, число протонов и электронов одинаково. Положительный заряд ядра атома имеет место быть как раз за счет протонов.
Определение заряда ядра атома
Необходимо запомнить, что порядковый номер химического элемента количественно совпадает с зарядом ядра атома. Поэтому, чтобы определить заряд ядра атома необходимо посмотреть, под каким номером находится данный химический элемент.
Примеры определения заряда ядра атома
Пример № 1. Определить заряд ядра атома углерода (С). Начинаем анализировать химический элемент углерод, ориентируясь на таблицу Д.И.Менделеева. Углерод находится в «квартире» № 6. Следовательно, он имеет заряд ядра +6 за счет 6 протонов (положительно заряженных частиц), которые располагаются в ядре. Учитывая, что атом электронейтрален, значит, электронов тоже будет 6.
Пример № 2. Определить заряд ядра атома алюминия (Al). Алюминий имеет порядковый номер - № 13. Следовательно, заряд ядра атома алюминия +13 (за счет 13 протонов). Электронов также будет 13.
Пример № 3. Определить заряд ядра атома серебра (Ag). Серебро имеет порядковый номер - № 47. Значит, заряд ядра атома серебра +47 (за счет 47 протонов). Электронов также 47.
Обратите внимание, в таблице Д.И.Менделеева в одной клетке для каждого химического элемента указаны два числовых значения. Не путайте порядковый номер и относительную атомную массу элемента.