Как вычислить число протонов в ядре изотопа
- Структура атома по Бору и его составные части
- Химические свойства элементов и их зависимость от числа протонов
- Изотопы и их отличия
- Примеры изотопов водорода
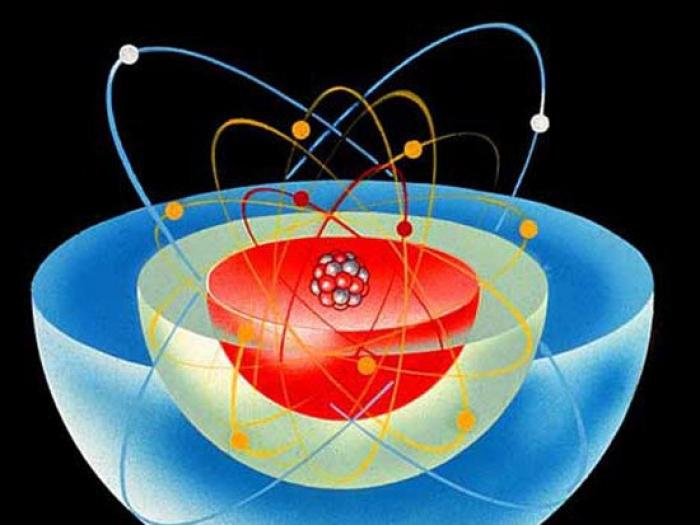
Структура атома по Бору и его составные части
Атомы состоят из нескольких субатомных частиц, включая протоны, нейтроны и электроны. Протоны, положительно заряженные частицы, находятся в центре атома, в его ядре. Чтобы определить число протонов в атоме, можно воспользоваться атомным номером соответствующего химического элемента.
Для описания свойств атома и его структуры используется модель, известная как "Модель атома по Бору". Согласно этой модели, атом имеет структуру, напоминающую солнечную систему, где тяжелое ядро находится в центре, а более легкие электроны движутся вокруг него на орбитах. Протоны и нейтроны составляют положительно заряженное ядро, а электроны, обладающие отрицательным зарядом, притягиваются к ядру электростатическими силами.
Химические свойства элементов и их зависимость от числа протонов
Элементом называется вещество, состоящее из атомов одного типа, которые определяются числом протонов. Каждому элементу присваивается свое имя и символ, например, водород (H) или кислород (O). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов в атомах. Нейтроны не имеют электрического заряда и не влияют на химические характеристики атома. Однако их число может влиять на стабильность ядра и общую массу атома.
Изотопы и их отличия
Изотопами называются атомы одного и того же элемента, имеющие различное число нейтронов. Химически они идентичны, однако отличаются своей массой и способностью к излучению. Атомный номер (Z) является порядковым номером химического элемента в периодической системе Менделеева и определяется числом протонов в ядре. Каждый атом характеризуется атомным номером и массовым числом (A), которое является суммой протонов и нейтронов в ядре. В то время как элемент может иметь атомы с различным числом нейтронов, количество протонов остается неизменным и равно числу электронов нейтрального атома. Для определения числа протонов в ядре изотопа достаточно посмотреть на его атомный номер, который соответствует номеру соответствующего химического элемента в периодической системе Менделеева.
Примеры изотопов водорода
Водород является хорошим примером для изучения изотопов. В природе наиболее распространены атомы водорода без нейтронов, имеющие один протон. Однако существуют изотопы водорода с одним или двумя нейтронами, которые имеют соответствующие названия. Несмотря на различную массу, все они имеют один протон, соответствующий порядковому номеру водорода в периодической таблице. Изотоп водорода с одним нейтроном и массовым числом 2 называется дейтерием или тяжелым водородом и является стабильным. Тритий, изотоп водорода с массовым числом 3 и двумя нейтронами, радиоактивен и иногда называется сверхтяжелым водородом. Ядро трития называется тритоном.