От чего зависят кислотно-основные свойства
- Кислотно-основные свойства химических элементов и их реакции
- Основные и кислотные свойства
- Реакции оксидов с водой
- Таблица Менделеева и кислотно-основные свойства
- Теории определения свойств
Кислотно-основные свойства химических элементов и их реакции
В химии существуют кислотно-основные свойства химических элементов, которые определяют их возможные реакции. Кислотно-основные свойства влияют не только на элементы, но и на их соединения.
Основные и кислотные свойства
Основные свойства проявляют металлы, их оксиды и гидроксиды. Кислотные свойства проявляются неметаллы, их соли, кислоты и ангидриды. Также существуют амфотерные элементы, которые могут проявлять как кислотные, так и основные свойства. Например, цинк, алюминий и хром являются представителями амфотерных элементов. Щелочные и щелочно-земельные металлы проявляют типичные основные свойства, в то время как сера, хлор и азот проявляют кислотные свойства.
Реакции оксидов с водой
При реакции оксидов с водой возникают различные продукты в зависимости от свойств основного элемента. Это может быть либо основание или гидроксид, либо кислота. Например, реакция оксида серы с водой приводит к образованию серной кислоты (SO3+H2O=H2SO4), а реакция оксида кальция с водой приводит к образованию гидроксида кальция (CaO+H2O=Ca(OH)2).
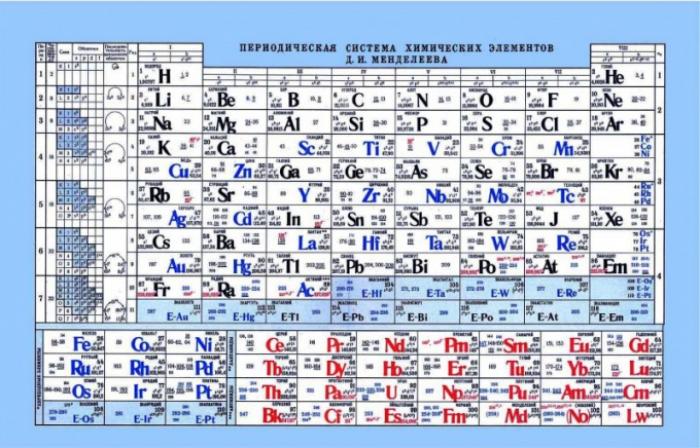
Таблица Менделеева и кислотно-основные свойства
Таблица Менделеева может быть полезна для определения кислотно-основных свойств элементов. По горизонтали в таблице усиливаются неметаллические или кислотные свойства. Металлы находятся ближе к левому краю, амфотерные элементы - по центру, а неметаллы - справа. При анализе электронов и их притяжения к ядру видно, что элементы в левой части имеют слабый заряд ядра, а электроны находятся на s-уровне. Это делает отдачу электрона проще для этих элементов, в отличие от элементов, находящихся в правой части. Неметаллы имеют высокий заряд ядра, что усложняет отдачу свободных электронов, и они проявляют кислотные свойства.
Теории определения свойств
Существуют три теории, которые определяют свойства соединений: протонная теория Бренстеда-Лоури, апротонная электронная теория Льюиса и теория Аррениуса.
Протонная теория Бренстеда-Лоури говорит о том, что кислотными свойствами обладают соединения, способные отдавать свои протоны. Основные свойства проявляются способностью принимать протоны.
Апротонная электронная теория Льюиса предполагает, что акцептирование и донорство протонов для определения кислотно-основных свойств необязательно. В данной теории кислотные свойства проявляются возможностью принять электронную пару, а основные свойства - отдать эту пару.
Теория Аррениуса является самой актуальной для определения кислотно-основных свойств. Она гласит, что кислотные свойства проявляются, когда химическое соединение при диссоциации в водных растворах разделяется на анионы и ионы водорода, а основные свойства проявляются на катионах и ионах гидроксида.






